Era da tempo che ne sentivamo parlare e con l’autunno è arrivato. Mi riferisco all’estetrolo (E4), il nuovo estrogeno introdotto per la preparazione contraccettiva, e non solo, dato che è in fase di ultimazione anche la approvazione del suo uso nella terapia ormonale sostitutiva (TOS).
Andiamo con ordine. A tutt’oggi la contraccezione ormonale rappresenta l’opzione contraccettiva più usata. Negli Stati Uniti su 40 milioni circa di donne in età fertile quasi il 70% usa un metodo contraccettivo di tipo ormonale scelto tra contraccettivi orali, impianti, anello vaginale e cerotto. Indubbiamente la caratteristica della contraccezione ormonale è di essere sicura e ottimale per il controllo non solo dell’ovulazione, che viene impedita, ma anche sull’endometrio. Di fatto l’uso di formulazioni sempre più definite e specifiche in termini biologici porta spesso, col progredire dell’intervallo di uso dei contraccettivi, ad avere un ottimo controllo delle perdite mestruali in almeno il 70-80% delle utilizzatrici. Questo è uno dei molti effetti non contraccettivi dei contraccettivi ormonali in specie di quelli orali. Con alta frequenza le donne in età fertile, fino anche a quelle attorno ai 40-42 anni di età, richiedono l’uso del contraccettivo ormonale per la gestione del sanguinamento sia in termini di frequenza come pure per ridurre o limitare l’entità delle perdite mestruali.
Fino ad oggi le preparazioni contraccettive ormonali hanno contenuto etinil estradiolo (EE) oppure estradiolo nella forma emidrata o valerata (1), in abbinamento con dei progestinici. E’ l’appropriatezza del bilancio tra la azione estrogenica e quella progestinica che conferisce al contraccettivo orale l’ottimale efficacia, equilibrando la tollerabilità con la sicurezza, avendo i minimi eventi avversi. Nel contraccetivo ormonale orale è il progestinico che fa la parte del maggiore effettore della inibizione della ovulazione con azione mirata sul muco cervicale che viene ispessito e reso più denso. Non a caso esistono preparazioni contraccettive fatte da soli progestinici. Gli estrogeni hanno anch’essi una azione sui meccanismi endocrini che portano all’ovulazione riducendo i livelli di FSH ma principalmente stabilizzano l’endometrio, regolando il sanguinamento mestruale.
La storia dei contraccettivi ormonali è partita ormai tanti anni fa, negli anni 50, con l’uso del mestrenolo ad un dosaggio di 75 µg che fu rapidamente ridotto a meno di 50 µg e poi sostituito dell’EE negli anni 60. Da questo momento l’EE è diventato l’estrogeno dei contraccettivi ormonali orali, quello che ha dato dimostrazione di migliore e più alta efficacia, sicurezza e tollerabilità (2).
Quando si parla dell’EE si deve però ricordare che questo può condizionare la funzione epatica modificando le sintesi di lipoproteine, angiotensina, sexual hormone binding protein (SHBG), cortiscosteroid binding protein (CBG) e la ceruloplasmina (3). Di fatto l’EE ha un impatto anche sull’endotelio e può essere trigger di rari eventi trombotici sia arteriosi che venosi che sono comunque legati al dosaggio usato (2). Sono le alte dosi di EE ad essere associate ad un maggiore rischio cardiovascolare tra cui il tromboembolismo, l’infarto in specie in donne che sono obese e/o sono fumatrici (4). La soluzione a questo tipo di rischio è stata adottata riducendo il dosaggio dell’EE nelle preparazioni contraccettive e usando progestinici con caratteristiche androgeniche minime o assenti. La riduzione del dosaggio di EE al di sotto dei 35 µg ha ridotto ma non eliminato questi rischi cardiovascolari. La vera evoluzione si è avuta con la sostituzione dell’EE con l’estradiolo che ha permesso di ridurre ulteriormente gli eventi avversi ( 1, 5). Il vantaggio di avere estradiolo e non EE sta nel fatto che quest’ultimo non è convertito in cataboliti utili per la biologia femminile e viene eliminato senza grandi altri effetti. Al contrario, l’uso dell’estradiolo permette di avere una sua evoluzione catabolica in estrone (E1) e in estriolo (E3) che ha effetti positivi in tutti gli organi estrogeno sensibili (1). Ma l’evoluzione è andata avanti e finalmente si è arrivati all’estetrolo (E4) (6, 7).
L’E4 è un estrogeno non certo nuovo dato che è stato identificato nel 1965 (7) ma solo recentemente si è pensato ad un suo uso nella contraccezione e nella TOS. L’E4 è un estrogeno prodotto dal feto umano, con una emivita lunga di circa 28-32 ore (7), con una particolare caratteristica di azione tissutale specifica, definita NEST (Native Estrogen Selective Tissue). Quale sia il senso dell’E4 per il feto non è ben chiaro ma si ritiene che sia un fattore di protezione di tipo vascolare in vista del travaglio di parto (8). L’E4 aumenta fin dall 9° settimana di gravidanza e diviene assai alto nel corso del 3° trimestre, molto più alto nel sangue fetale di quanto sia quello materno (9). L’azione degli estrogeni si realizza attraverso il loro legame con gli specifici recettori ERα e ERβ. Gli ERα sono localizzati sia nel nucleo che sulle membrane cellulari. Quelli che si trovano nel nucleo inducono la trascrizione genica mentre quelli delle membrane danno l’avvio a fenomeni di signaling dell’azione ormonale conosciuta come Membrane-Initiated Steroid Signaling (MISS) (10). Come l’estradiolo, anche E4, legandosi agli ERα nucleari, attiva le trascrizioni geniche ma al contrario degli altri estrogeni, l’E4 antagonizza/blocca i recettori ERα di membrana, indicendo nessun effetto a livello epatico e minimo o neutrale sulla mammella (11, 12). L’azione a livello nucleare dell’E4 ha effetti benefici su organi come vagina, endometrio, osso e sistema cardiovascolare. L’E4 non è un SERM in quanto non induce cambiamenti conformazionali dei recettori per gli estrogeni e la sua azione ottimale nasce dall’equilibrio tra gli effetti di blocco sui recettori di membrana e di attivazione di quelli nucleari.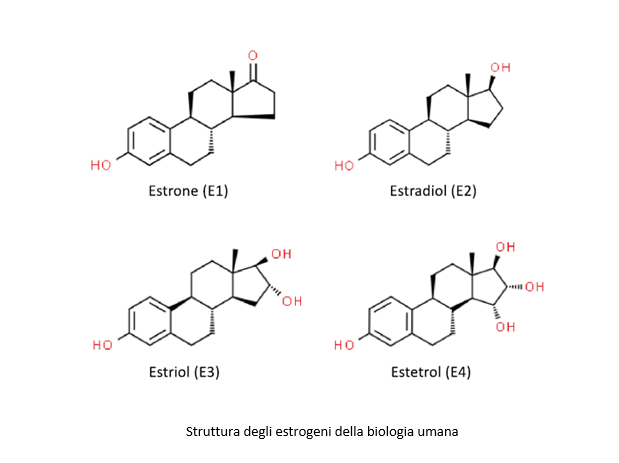
Proprio per queste caratteristiche l’E4 è stato considerato un estrogeno utile per la contraccezione come, probabilmente, per la terapia ormonale sostitutiva. In fatti gli studi preclinici fatti fino ad ora hanno ampiamente dimostrato che l’abbinamento dell’E4 con il drospirenone (DSP), uno dei progestinici di minore impatto biologico, è assolutamente ottimale (13). La combinazione E4/DSP (15 mg/3 mg) si è dimostrata avere minimo impatto su l’emostasi, fattori della coagulazione, fibrinolisi, angiotensinogeno, colesterolo e trigliceridi (14, 15) con un controllo ottimale dell’endometrio anche in confronto alla combinazione E4/Levonorgestrel (16). Di fatto le caratteristiche dell’E4 sono quindi tali da migliorare gli effetti dell’EE e dello stesso E2, mantenendo l’efficacia contraccettiva.
A cosa siamo quindi di fronte? certamente ad un importante salto di qualità nella contraccezione e prossimamente anche nella TOS. Per quanto attualmente si sa, la sicurezza dell’E4 è notevole ad ogni livello, neutra a livello mammario, ottima per l’endometrio e l’osso, certamente ottimale quando in combinazione col DSP per la contraccezione. Per quanto attualmente noto, l’E4 è efficace anche nel trattare i sintomi vasomotori con dosi che risultano neutre sulle cellule di tumore mammario (17). Siamo quindi prossimi ad una evoluzione nelle terapie ormonali. Ogni ginecologo vorrebbe che l’estrogeno delle preparazioni ormonali fosse quello ideale: efficace sui sintomi della menopausa e su tutti i tessuti colpiti dell’ipoestrogenismo menopausale, neutrale sulla mammella e sul K mammario, neutrale sull’endometrio impedendo iperplasia e evoluzione a K endometriale, cardioprotettivo e anti-aterosclrotico e anti-trombotico, favorevole ed ottimale verso il metabolismo e il profilo lipidico (17).
Probabilmente l’E4 si avvicina molto a questo estrogeno ideale e favorevole per la donna.
Bibliografia
- Genazzani AD. L’evoluzione del contraccettivo, dell’estrogeno e della logica mestruale. Editoriale. Boll Ginecol Endocrinol 4-5, 2015
- Hall KS, Trussell J. Types of combined oral contraceptives used by U.S. women. Contraception. 2012;86(6):659-665.
- Bitzer J. Pharmacological profile of estrogens in oral contraception. Minerva Ginecol. 2011;63(3):299-304.
- Taylor HS, Pal L, Seli E. Speroff’s Clinical Gynecologic Endocrinology and Infertility. 9th ed. Philadelphia, PA: Wolters Kluwer; 2020.
- Kavanaugh ML, Jerman J. Contraceptive method use in the United States: trends and characteristics between 2008, 2012 and 2014. Contraception. 2018;97(1):14-21.
- Hagen AA, Barr M, Diczfalusy E. Metabolism of 17β-oestradiol-4-14C in early infancy. Acta Endocrinol. 1965;49:207-220
- Visser M, Holinka CF, Coelingh Bennink HJT. First human exposure to exogenous single-dose oral estetrol in early postmenopausal women. Climacteric. 2008; 11:31–40.
- Tulchinsky D, Frigoletto FD Jr, Ryan KJ, et al. Plasma estetrol as an index of fetal well-being. J Clin Endocrinol Metab. 1975;40(4):560-567.
- Coelingh Bennink F, Holinka CF, Visser M, Coelingh Bennink HJT. Maternal and fetal estetrol levels during pregnancy. Climacteric. 2008; 11:69–72
- Arnal JF, Lenfant F, Metivier R, et al. Membrane and nuclear estrogen receptor alpha actions: from tissue specificity to medical implications. Physiol Rev. 2017;3:1045-1087.
- Gérard C, Blacher S, Communal L, et al. Estetrol is a weak estrogen antagonizing estradiol-dependent mammary gland proliferation. J Endocrinol. 2015;224(1):85-95.
- Gérard C, Mestdagt M, Tskitishvili E, et al. Combined estrogenic and anti-estrogenic properties of estetrol on breast cancer may provide a safe therapeutic window for the treatment of menopausal symptoms. Oncotarget. 2015;6(19):17621-17636.
- Geraghty P, Taylor HS. The next generation of oral contraception: advances in estrogens. ObGyn Management, June 2021
- Mawet M, Maillard C, Klipping C, et al. Unique effects on hepatic function, lipid metabolism, bone and growth endocrine parameters of estetrol in combined oral contraceptives. Eur J Contracept Reprod Health Care. 2015;20(6):463-475.
- Kluft C, Zimmerman Y, Mawet M, Klipping C, Duijkers IJM, Neuteboom J, Foidart JM, Bennink HC. Reduced hemostatic effects with drospirenone-based oral contraceptives containing estetrol vs. ethinyl estradiol. Contraception 2017, 95, 140–147.
- Duijkers IJM, Klipping C, Zimmerman Y, et al. Inhibition of ovulation by administration of estetrol in combination with drospirenone or levonorgestrel: results of a phase II dose-finding pilot study. Eur J Contracept Reprod Health Care. 2015;20(6):476-489.
- Gallez A, Da Silva ID, Wuidar V, Foidart JM, Pequeux C. Estetrol and mammary gland: friends or foes ? J Mamm Gland Biol 2021, 26: 297-308